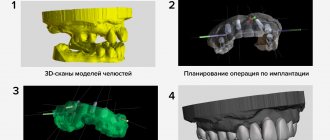
Остеоинтеграция в дентальной имплантации – процесс приживления зубного имплантата в костной ткани. При положительном эффекте челюстная кость «принимает» металлический искусственный корень, не отторгает инородное тело и в дальнейшем нормально функционирует.
Само понятие «остеоинтеграция имплантата» стало популярным в конце XX века, когда в современной стоматологии начала активно развиваться имплантология. Впервые же о данном процессе заговорили в 1965 году, когда шведские ученые исследовали процесс регенерацию костной ткани после полученных человеком травм.
Факторы влияющие на успешность остеоинтеграции
Успешность приживления искусственного корня зависит от:
- изначального диагноза;
- вида и качества имплантата;
- хирургической техники во время операции;
- поверхности и формы искусственного корня;
- индивидуальных особенностей организма;
- наличия аллергии;
- возраста пациента;
- общего состояния ротовой полости;
- перенесенных заболеваний в прошлом и т. п.
Важно! Успешный «ответ» организма на внедрение искусственного корня не является 100%-ной гарантией успеха всего процесса имплантации, хотя и объективно считается ключевым моментом. В отдельных случаях, даже при успешном остеоинтегрировании, может быть неудачно выбрано место для установки имплантата, или же был выбран некачественный протез.
Материал и форма имплантата играют роль
Для успешного приживления в кости материал искусственного корня должен быть инертным, чтобы не вызывать негативной реакции организма. Этому требованию отвечают такие материалы:
- биоинертные – титановый сплав, цирконий, никелид титана, золото и др.
- биотолерантные – сплав хрома и кобальта;
- биоактивные – металл, покрытый кальций-фосфатным или керамическим слоем, пористое покрытие.
Исходя из опыта внедрения искусственных корней, и общей статистики приживления имплантатов, лучшими считаются:
- винтовые
- цилиндрические;
- в форме природного зуба;
- с кортикальными накладками и др.
Основные стадии остеоинтеграции
- Перед началом имплантации исследуется костная ткань пациента: структура, плотность, объем, строение и др. Определяется уровень резорбции тканей, соотношение губчатого вещества и так называемой кортикальной пластины;
- Если объема кости недостаточно, выполняется наращивание или синус-лифтинг. Все это делается во избежание механической перегрузки, что может негативно сказаться на процессе приживления корня.
- После внедрения имплантат нельзя нагружать во избежание формирования фиброзной капсулы.
- Через 3 – 6 месяцев трабекулярная кость начинает укрепляться. В целом, на полное и окончательное укрепление кости необходимо около полутора лет. Но, если через полгода процесс успешно завершен, новый корень можно смело нагружать коронкой.
- 5. В этот период важно наблюдаться у лечащего стоматолога, чтобы контролировать процесс визуально и с помощью специальной аппаратуры. При необходимости специалист назначит курс лечения с целью ускорения и улучшения качества костной интеграции.
Обратите внимание! Первые две-три недели после внедрения корня являются показательными для его приживления. Именно в первые дни вокруг штифта формируется так называемая трабекулярная кость. Именно поэтому на корень не ставят коронку, чтобы не нарушить первичный процесс остеоинтеграции.
Радует то, что современные технологии дают высокие гарантии успешного приживления имплантатов. Чтобы корень прижился быстро, важно:
- ставить имплантат проверенного производителя;
- обращаться за помощью к опытному стоматологу-имплантологу, который специализируется на установке искусственных корней;
- соблюдать рекомендации после внедрения корня (регулярно чистить зубы, соблюдать диету, не нагружать оперируемую зону, отказаться от алкоголя и курения).
Период полного приживления
Сроки приживления дентальной конструкции на верхней и нижней челюсти разные. Для нижней достаточно 4 месяцев. Верхняя нуждается в более длительном периоде. В среднем, требуется около полугода. Разница в сроках обусловлена разной плотностью тканей и получаемой нагрузкой. Верхняя челюсть обладает меньшей плотностью, нагрузка не нее не столь ощутима.
После первого этапа приживления изготавливается ортопедическая конструкция. Это необходимо для получения жевательного давления на имплант. Получаемая нагрузка будет воздействовать на кость, стимулировать рост клеток, предотвращать рецессию. Полная остеоинтеграция произойдет через полтора года после установки.
Достижение контакта между костью и дентальной конструкцией не гарантирует успех имплантации. Иногда отторжение может произойти по причине неправильного размещения импланта, его некачественного протезирования.
Осложнения при неудачной остеоинтеграции
Самым распространенным осложнением является переимплантит, то есть воспаление вокруг внедренного искусственного корня. При таком диагнозе костная ткань постепенно убывает, и по итогу корень отторгается. Проблема возникает из-за случайного попадания в лунку инфекции, неправильного ухода за полостью рта после имплантации, сильная нагрузка или травма кости, чрезмерный размер костного ложа и другие факторы.
Для коррекции состояния имплант изымается из лунки, удаляется гнойник и десневой карман. Десна обрабатывается антибактериальным составом, назначаются физиопроцедуры для восстановления мягких тканей. Через несколько месяцев назначается повторная имплантация.
Немного истории
Явление остеоинтеграции открыл шведский ученый Пер-Ингвар Бранемарк, занимающийся исследованиями в Гётеборгском университете. В 1965 году он изучал процессы восстановления костных структур после травмирования. Были проведены опыты на кролике. В тазобедренную кость животному установили титановый датчик. По прошествии времени обнаружилось, что извлечь датчик невозможно — он сросся с костной тканью. Так было выяснено, что титан биоинертен, то есть совместим с тканями человека. Обнаружение явления было очень значимо для многих областей медицины. В стоматологии открытие стало началом разработки систем восстановления зубов.
Как выбрать клинику в Москве, чтобы гарантировать успешную остеоинтеграцию?
Сеть клиник «32 Дент» специализируется на имплантации зубов. Именно поэтому, согласно статистике, у пациентов «32 Дент» почти в 100% отмечается успешная остеоинтеграция. Качественные имплантаты производства Израиля, Швейцарии, США, работа опытных специалистов, современная аппаратура – все это является залогом успешного приживления нового зуба. Убедиться в этом стоит, записавшись на прием к имплантологу уже сейчас!
Если у вас возникла проблема, похожая на описанную в данной статье, обязательно обратитесь к нашим специалистам. Не ставьте диагноз самостоятельно!
Почему стоит позвонить нам сейчас:
- Ответим на все ваши вопросы за 3 минуты
- Бесплатная консультация
- Средний стаж работы врачей – 12 лет
- Удобство расположения клиник
Единый контактный телефон: +7
Записаться на прием
Источники:
- Личный опыт работы стоматологом-имплантолом;
- Воробьев, А. А. Взгляд на проблему дентальной имплантации в свете современных научных представлений / А. А. Воробьев, В. И. Шемонаев, Д. В. Михаль-ченко, А. С. Величко // Волгоградский научно-медицинский журнал. — 2009;
- Сирак, С. В. Непосредственная дентальная имплантация у пациентов с включенными дефектами зубных рядов / С. В. Сирак, А. А. Слетов, К. С. Гандылян, М. В. Дагуева // Медицинский вестник Северного Кавказа. — 2011;
- Esposito, M. Interventions for replacing missing teeth: different types of dental implants / M. Esposito, Y. Ardebili, H. V. Worthington // Cochrane Database Syst. Rev. — 2014;
- Dental implants are a viable alternative for compensating oligodontia in adolescents / S. Heuberer, G. Dvorak, C. Mayer, G. Watzek, W. Zechner // Clin. Oral Implants Res. — 2015;
- Immediate loading implants: review of the critical aspects / L. Tettamanti, C. Andrisani, M. A. Bassi, R. Vinci, J. Silvestre-Rangil, A. Tagliabue // Oral Implantol. — 2017;
- Параскевич, В. Л. Дентальная имплантология: основы теории и практики / В. Л. Параскевич. — Минск : Юнипресс, 2002;
- Лабис, В. В. Роль бактериального фактора и иммунной системы в процессе репаративного остеогенеза при дентальной имплантации / В. В. Лабис, Э. А. Ба-зикян, И. Г. Козлов // Бюллетень Оренбургского научного центра УрО РАН. — 2013;
- Алейникова, Е. В. Современная концепция остеоинтеграции дентальных имплантатов / Е. В. Алейникова, А. Б. Шабанович // Медицинский журнал. — 2006;
- Влияние физико-химических свойств поверхности титановых имплантатов и способов их модификации на показатели остеоинтеграции / Г. А. Воложин, A. П. Алехин, А. М. Маркеев, Д. В. Тетюхин, Е. Н. Козлов, М. А. Степанова // Институт стоматологии. — 2009.
По данным ВОЗ, у 75% населения в различных регионах мира частично отсутствуют зубы, а примерно у 30% людей в возрасте 65—74 лет естественные зубы отсутствуют полностью [1]. На фоне столь высокой распространенности адентии развивается рынок дентальных имплантатов [2—7]. Ожидается, что к 2022 г. предполагаемый американский и европейский рынок зубных имплантатов достигнет 4,2 млрд долларов США [6].
По сравнению с традиционными съемными ортопедическими конструкциями дентальные имплантаты имеют лучшую функциональность, значительно повышают качество жизни пациента и обеспечивают более качественный эстетический эффект [8—10].
Одним из главных условий успешной дентальной имплантации является достаточная первичная стабилизация имплантата в костной ткани, от которой напрямую зависит приживаемость имплантата в целом. Микроэкскурсия более 50—100 мкм вызывает образование волокнистой соединительной ткани и резорбцию костной ткани на границе между костью и имплантатом, что негативно влияет на остеоинтеграцию и ремоделирование кости [11—13]. Еще большее значение первичная стабильность имплантатов приобрела в связи с внедрением в практику протоколов ранней и немедленной нагрузки [14, 15].
Первичная стабильность зависит от геометрии имплантата, его топографии, а также протоколов остеотомии, которые регулируют напряжение, приложенное к костной ткани в непосредственной близости от имплантата [16].
В случае оптимального течения процесса интеграции между дентальным имплантатом и прилежащими костными структурами формируется непосредственный контакт без участия промежуточной соединительнотканной прослойки. Такой тип соединения имплантата и костной ткани называют остеоинтеграцией [5, 17, 18].
Основным фактором, определяющим стабильность имплантата, являются характеристики его поверхности [17, 11, 19, 20]. Все наиболее важные исследования, выполненные в последние годы в области повышения эффективности дентальных имплантатов, как правило, связаны с развитием технологий обработки их поверхности [14, 21—23].
На первых этапах интеграции большую роль в обеспечении первичной стабильности имплантата играет макротопография его поверхности. Кроме формы внутрикостной части (цилиндрическая/коническая), к ней относятся степень соответствия имплантата размеру высверленного в костной ткани канала и наличие крупных нарезок на имплантате [24, 25].
Оптимизации процесса остеоинтеграции и улучшению механических свойств окружающей костной ткани также способствуют особенности микротопографии имплантата. Наличие микродефектов на поверхности имплантата увеличивает площадь контакта и позволяет остеогенным клеткам прикрепляться к поверхности имплантата с помощью структурных белков и гликопротеинов, тем самым способствуя остеогенезу [26, 27].
Структура поверхности, морфология и химический состав дентального имплантата могут быть изменены двумя способами: химическим и физическим [28]. Наиболее часто используемый метод для изменения поверхности имплантата на наноуровне — химический. Он включает анодное оксидирование, кислотное травление, щелочное травление, сочетание анодного оксидирования и травления, обработку перекисью водорода и золь-гель-методом, а также химическое осаждение [29—32]. Кислотное травление поверхности имплантата (используются соляная, серная, азотистая и плавиковая кислоты) приводит к образованию на поверхности имплантата микроуглублений диаметром от 0,5 до 2 мкм. Это создает однородную шероховатость, увеличенную площадь активной поверхности и улучшает адгезию клеток, а следовательно, обеспечивает оптимальную остеоинтеграцию [30, 32, 33]. Одним из методов, используемых для обработки поверхности имплантатов, являются увеличение толщины и изменение кристаллической структуры слоя оксида титана на поверхности путем анодирования. Особенность электрохимического анодного окисления заключается в возможности создания эффективной поверхности шейки имплантата, контактирующей с мягкими тканями, в результате чего формируется десневой сосочек [29, 31, 34].
Среди физических способов модификации поверхности имплантата наиболее часто используется пескоструйная обработка [35, 36]. Частицы песка (оксиды кремния, алюминия и/или оксид титана), попадая на поверхность имплантата, образуют на ней микровдавления. Шероховатость зависит от размера и массы частиц, а также скорости их движения, времени воздействия, расстояния от источника распыления до поверхности имплантата [37, 38]. Так как после обработки некоторые частицы крепко впечатываются в поверхность, то часто для гомогенизации микропрофиля поверхности проводят кислотное травление фтористо-водородной, азотной или серной кислотами [39]. При контакте клеток с развитой поверхностью имплантата улучшаются их адгезия, пролиферация и дифференцировка остеобластов.
В последнее время было разработано несколько новых технологий покрытия с нанесением гидроксиапатита и фосфатов кальция (CаP) на поверхность имплантатов [40—42]. Было доказано, что CaР способствует формированию прямой связи с костной тканью по сравнению с имплантатами без дополнительного покрытия титановой поверхности [41]. Клинические исследования имплантатов такого типа ограничены, однако есть основания полагать, что они могут быть более эффективными при ранней функциональной нагрузке [43, 44].
Кроме того, к одним из наиболее распространенных методов обработки поверхности относится лазерная абляция, которая позволяет создать микрокаверны — полости диаметром в несколько микрометров с упорядоченно запрограммированной структурой [45, 46].
Отдельную группу составляют биоактивные модификации поверхности дентальных имплантатов [47, 48]. В основном применяют различные остеоиндуктивные факторы роста [49—51]. Кроме того, для снижения риска развития инфекционных осложнений широко используется нанесение на поверхность имплантатов антибактериальных препаратов [3, 52, 53].
Еще одним важным фактором, влияющим на остеоинтеграцию, является гидрофильность/гидрофобность. В исследовании R. Baier, D. Meyer (1988) было показано, что гидрофильные материалы (поверхностное натяжение выше 30 дин/см) вступают в более тесное взаимодействие с биологическими жидкостями, клетками и тканями и соответственно способствуют лучшему процессу остеоинтеграции [18, 54]. Определенную роль в этом процессе также играет шероховатость поверхности имплантата. Фибробласты и эпителиальные клетки сильнее склеиваются с гладкими поверхностями, а способность к пролиферации остеобластов и синтезу коллагена более выражена на поверхности с умеренной шероховатостью [55, 56].
Общий принцип для современных имплантационных дентальных конструкций заключается в достижении оптимального биомеханического состояния за счет строгого соблюдения хирургического протокола инсталляции, обеспечения регенерации и ремоделирования костной ткани вокруг имплантата [57, 58]. В 95% случаев эта цель достигается за счет успешного процесса остеоинтеграции. В связи с этим обеспечение оптимальных условий процесса остеоинтеграции — ключевая задача любого хирурга-стоматолога [59, 60]. Помимо характеристик поверхности имплантата, на остеоинтеграцию влияют другие факторы: дизайн имплантатов, характеристики имплантационного материала, состояние прилежащей кости, хирургическая техника и нагрузка на имплантат [59, 61—65].
Основным требованием к выбираемому для имплантации материалу является его биосовместимость, которая определяется химическим составом, механическими и электрическими свойствами материала, а также особенностями поверхности [67—68]. Кроме того, материал не должен вызывать токсических реакций, быть канцерогенным, аллергенным и радиоактивным [69].
Большей части требований, предъявляемых к материалам, применяемым в дентальной имлантологии, соответствуют титан и его сплавы [61, 70—72]. Для них характерны высокая упругость и низкая плотность, благодаря чему их прочность выше, чем прочность других металлов. При введении титановых имплантатов в ткань прямого контакта между титаном и тканями организма не происходит, так как титан способен образовывать на поверхности имплантата тонкую оксидную пленку, которая повышает антикоррозийные свойства материала и благодаря стабильным и высокоплотным оксидам обладает высокой вязкостью и хорошей адгезией [73—75].
Известен также ряд других материалов, которые способны образовывать прочное соединение с костью. К ним относятся цирконий и некоторые керамические материалы [66, 76—80].
У исследователей нет единого мнения относительно лучшей формы имплантатов, но общеизвестно, что геометрическая форма должна обеспечить максимальную зону контакта костного имплантата с тканью и уменьшить напряжение вблизи области шейки имплантата [81]. В настоящее время наиболее активно используют цилиндрические и конические имплантаты [82]. Последние хорошо зарекомендовали себя в условиях низкой костной плотности [82—84], поскольку наибольшая часть нагрузки распространяется в аксиальном направлении, в котором площадь конического имплантата выше [85, 86].
На стабильность имплантатов значительное влияние оказывает форма соединения с протезом [87]. На мировом стоматологическом рынке доминируют винтовые имплантаты. Поверхность винта обеспечивает большую площадь контакта между имплантатом и костью, увеличивает первичную стабильность, уменьшает напряжение сдвига в интерфейсе костного имплантата и концентрацию напряжений в области шейки имплантата [88, 89]. Для имплантатов нескольких зубов используют более сложные формы соединения — гексагональные соединения и соединения на основе конуса Морзе [13, 90, 91].
Среди хирургических факторов, которые влияют на остеоинтеграцию, решающее значение имеет подготовка костного ложа [92—95]. Механические и термические повреждения ткани, возникающие при формировании ложа имплантата, могут оказывать разрушающее действие на исходную костную ткань и результат хирургического лечения [96, 97]. Если температура сверления во время формирования костного ложа превышает 47 °C в течение 1 мин, то возможно возникновение теплового остеонекроза — вокруг имплантата формируется фиброзная капсула, и прочность его соединения с костью значительно снижается [17]. В экспериментальном исследовании S. Yeniyol и соавт. [98] было установлено, что оптимальная с точки зрения успешности процесса остеоинтеграции скорость сверления ложа составляет 1000 об/мин [98]. Методика препарирования костного ложа под имплантат также имеет большое значение. Например, С. Stacchi и соавт. [99] в рандомизированном контролируемом клиническом исследовании показали, что коэффициент стабилизации имплантатов, установленных с помощью пьезоэлектрических инструментов, на 21-й день снижается на 2,7%, а при установке с помощью вращающихся фрез — на 9,2% (р
<0,0001) [99].
Общая стабилизация имплантата может рассматриваться как комбинация первичной и вторичной стабилизации [100]. Как отмечалось ранее, в успешной остеоинтеграции ключевую роль играет первичная стабильность, определяющаяся механической блокировкой между костью и имплантатом, без осуществления биологического взаимодействия. Первичная стабильность зависит от геометрии и топографии имплантата, а также протоколов остеотомии, которые регулируют напряжение, приложенное к костной ткани в непосредственной близости от имплантата [16, 17, 101].
Таким образом, результат дентальной имплантации определяется многофакторностью процесса, и его успешность зависит от консолидированных усилий производителей имплантатов и специалиста, выполняющего данную процедуру.
Успех дентального имплантологического лечения во многом зависит от состояния костной ткани челюстей [102— 104]. По данным ряда авторов, частота возникновения осложнений у пациентов с остеопенией и остеопорозом в раннем и позднем послеоперационном периоде может варьировать от 5 до 56% [105, 106]. Поэтому еще на самом начальном этапе имлантирования необходимо четко определить объем костной ткани и выявить качество кости альвеолярного отдела челюсти [107, 108].
Самым простым клиническим способом оценки стабильности имплантата является непосредственное тактильное восприятие хирурга. Однако ясно, что подобный опыт не может лежать в основе эффективных протоколов имплантации [15, 109].
Метод первичного прогнозирования стабильности, основанный на компьютерном расчете энергии, затраченной на высверливание определенного объема костной ткани, позволяет оценить плотность костной ткани в области имплантации, что коррелирует с его первичной стабильностью [19, 109].
Ряд методов, объединяемых как модальный анализ, основан на обработке ответа имплантата на определенное внешнее физическое воздействие. К их числу относятся перкуссионный тест, метод ударного воздействия, метод пульсирующих осцилляций и др. [109—111]. Более объективный и распространенный метод измерения стабильности имплантата основан на стандартном физическом воздействии и анализе звукового ответа с помощью быстрого преобразования Фурье или других методов обработки сигнала [111]. По схожему принципу действует также метод Dental mobility checker [40].
Двухмерная рентгенография позволяет оценить плотность костной ткани в области имплантации, определить участки низкой плотности, таким образом прогнозируя дальнейшую устойчивость имплантата [111]. Самым точным рентгенологическим методом является конусно-лучевая компьютерная томография [112, 113].
Резонансно-частотный анализ широко используется в стоматологической практике в исследованиях, посвященных применению различных режимов имплантации, типов имплантатов и изучению факторов, влияющих на остеоинтеграцию [114, 115]. Современные аппараты для резонансно-частотного анализа в отличие от других приборов для оценки стабильности имплантата бесконтактны и не оказывают влияния на состояние имплантата [116, 117].
В настоящее время с точки зрения функциональной нагрузки в дентальной имплантологии существует два метода решения этого вопроса: традиционный метод отложенной функциональной нагрузки и активно развивающийся в последние три десятилетия метод ранней нагрузки [12, 70, 81, 118]. Последний широко распространен в связи с внедрением в клиническую практику протокола одноэтапной имплантации [119—123].
Ранняя нагрузка указывает на возможность применения окклюзионной нагрузки на зубные имплантаты раньше, чем пройдет традиционный период заживления от 3 до 6 мес [124—126].
Эффективность протокола ранней нагрузки в отдельности и по сравнению с традиционной техникой отложенной нагрузки изучалась во многих экспериментальных и клинических исследованиях [70, 119, 127—130].
Р. Mura (2012) [131] исследовал эффективность протокола ранней нагрузки у 48 пациентов (79 имплантатов). Пятилетняя выживаемость имплантатов составила 100%, а средний уровень потери кости — 0,56 мм. L. Bogaerde и соавт. (2010) [132] в своем исследовании (n
=21, 69 имплантатов) отмечают приживаемость имплантатов, подвергнутых ранней функциональной нагрузке, в 98,5% в течение периода наблюдения (18 мес). При этом средняя маргинальная потеря кости составила 0,7 мм, а средний коэффициент устойчивости имплантата — 73,7. Авторы отмечают сопоставимость эффективности лечения с показателями протокола с отложенной нагрузкой.
А. Pozzi и соавт. (2015) [133] в течение 3 лет изучали эффективность немедленной нагрузки при непосредственной установке имплантатов (n
=54, всего 118 имплантатов). По результатам исследования, всего 1,9% имплантатов были потеряны из-за периимплантита у курящих пациентов. В исследовании А. Pozzi (2016) [134] 148 имплантатов (NobelReplace) были помещены как в послеэкстракционные лунки (
n
=67), так и в уже зажившие (
n
=81). Совокупный показатель успеха составил 99,3%. Средняя потеря костной ткани через 2 года после имплантирования в постэкстракционных участках составила 0,69±0,75 мм, а в заживленных лунках 0,62±0,80 мм (разница не достигла статистической значимости) [134]. Еще в одном исследовании не было выявлено достоверных различий по устойчивости дентальных имплантатов BoneTrust plus, установленных в лунку удаленного зуба, при немедленной нагрузке временными несъемными протезами и при отсроченной нагрузке (
p
>0,5) [37].
Ж.А. Ашуев (2012) [70] в экспериментальном исследовании на лабораторных мини-пигах показал, что при ранней функциональной нагрузке на дентальные имплантаты в регионарных сосудах и микроциркуляторном русле опорных тканей развивается гиперемия, которая сопровождается усилением тканевого кровотока и вазомоторной активности микрососудов, обеспечивая тем самым процесс остеоинтеграции. Функциональная активность жевательных мышц при ранних функциональных нагрузках на зубные имплантаты увеличивается, а их координированная работа восстанавливается уже через 3 мес [70].
В настоящее время нельзя недооценивать социальную значимость адентии. Функциональные и эстетические проблемы, связанные с потерей зубов, резко снижают качество жизни пациентов и служат причиной различного рода психологических нарушений [122, 135—137]. Режим функциональной нагрузки напрямую влияет, с одной стороны, на состояние костной ткани, с другой — на качество жизни пациента в период после имплантации [100].
А.А. Кулаков и Ж.А. Ашуев (2007) [138], основываясь на данных своих экспериментальных исследований, отмечают, что немедленная функциональная нагрузка имеет значительные преимущества перед традиционным протоколом отложенной нагрузки. Прежде всего это уменьшение числа травматических этапов вмешательства и послеоперационных ограничений, существенное сокращение сроков лечения, поддержка высоты и ширины альвеолярной кости на постоянном уровне, а также ускорение процессов регенерации кости [138]. Клиническое исследование, проведенное G. Romanos (2015) [139], показало, что, функционально нагружая кость сразу после немедленной имплантации, можно контролировать резорбцию костной ткани [139]. Существенным преимуществом метода ранней нагрузки является возможность восстановления зубов даже при запущенном пародонтозе [140, 141].
Таким образом, основной проблемой применения протокола ранней функциональной нагрузки является обеспечение первичной стабильности имплантата [142], а основными причинами неудачной имплантации — низкая плотность и качество костной ткани [143, 144]. Кроме того, при планировании немедленной функциональной нагрузки большое значение придается выбору формы имплантата. В литературе указано, что наиболее предпочтителен выбор имплантатов с резьбой, имеющих большую площадь контакта с костной тканью и менее мобильных [145]. Дополнительно стабильность повышается при наличии микрорезьбы на шейке имплантата. Однако хорошее состояние костной ткани может компенсировать неадекватный дизайн имплантата [146—147].
Дентальная имплантация становится все более и более доступной для широкого круга потребителей. Вместе с тем современные способы и средства, применяемые в дентальной имплантологии, позволяют провести процедуру практически при любых анатомических условиях.
Ввиду важности ранней реабилитации пациентов с частичной и полной утратой зубов при использовании зубных имплантатов проблема поиска оптимальных сроков функциональной нагрузки на зубные имплантаты становится все более актуальной. Большинство опубликованных исследований носит экспериментальный характер и ограничено малыми объемами наблюдений. Таким образом, дальнейшие исследования в области методов оптимизации контакта имплантата и кости, а также механизмов остеоинтеграции в зависимости от сроков функциональной нагрузки потенциально позволят повысить качество лечения при использовании имплантатов.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Для корреспонденции:
Порфенчук Дмитрий Александрович — аспирант 2-го года обучения в ФГБУ «ЦНИИС и ЧЛХ» в отделении клинической экспериментальной имплантологии; e-mail; тел.: +7(903)244-4292