| Фтор | |
| Атомный номер | 9 |
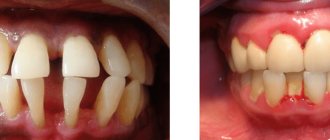
| Внешний вид простого вещества | Фтор в сосуде Бледно-жёлтый газ, чрезвычайно химически активен. Очень ядовит. |
| Свойства атома | |
| Атомная масса (молярная масса) | 18,998403 а. е. м. (/моль) |
| Радиус атома | 71 пм |
| Энергия ионизации (первый электрон) | 1680,0 (17,41) кДж/моль () |
| Электронная конфигурация | [He] 2s2 2p5 |
| Химические свойства | |
| Ковалентный радиус | 72 пм |
| Радиус иона | (-1e)133 пм |
| Электроотрицательность (по Полингу) | 3,98 |
| Электродный потенциал | 0 |
| Степени окисления | −1 |
| Термодинамические свойства простого вещества | |
| Плотность | (при −189 °C)1,108 /³ |
| Молярная теплоёмкость | 31,34 /(·моль) |
| Теплопроводность | 0,028 /(·) |
| Температура плавления | 53,53 |
| Теплота плавления | (F-F) 0,51 кДж/моль |
| Температура кипения | 85,01 |
| Теплота испарения | 6,54 (F-F) кДж/моль |
| Молярный объём | 17,1 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | 5,50 b=3,28 c=7,28 β=90.0 |
| Отношение c/a | — |
| Температура Дебая | n/a |
| F | 9 |
| 18,9984 | |
| [He]2s22p5 | |
| Фтор | |
Фтор
— элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Менделеева, с атомным номером
9
. Обозначается символом
F
Fluorum. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество
фтор
(CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор (формула F2). Очень ядовит.
История
Схема атома фтора
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere
— «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Фтор: разрушающий или созидающий?
Александр Рулёв, доктор химических наук,
Иркутский институт химии им. А. Е. Фаворского СО РАН
«Наука и жизнь» №10, 2019
Написать эту небольшую заметку меня побудило желание рассказать об удивительном элементе, а также поведать о его органических соединениях, показать, насколько сильно введение фтора в молекулу может изменить её свойства. В этом наша научная группа убеждалась всякий раз, когда, разрабатывая методы сборки фторированных азотсодержащих гетероциклов, открывала новые неожиданные реакции.
Среди всех химических элементов ему больше всего подходит облик древнеримского бога Януса, имеющего, как известно, два лица. Он — обладатель уникальной реакционной способности, энергично взаимодействующий почти со всеми элементами, и в то же время его соединения характеризуются высокой химической стойкостью. Он возглавляет 17 группу таблицы элементов и самый распространённый в земной коре среди всех галогенов, несмотря на то, что в индивидуальном виде был получен последним из них (не считая, разумеется, радиоактивных астата и теннессина). Будучи самым электроотрицательным элементом, позволяет достаточно уверенно предсказывать его влияние на свойства молекулы, хотя до сих пор любит преподносить учёным сюрпризы. Он — необходимый для здоровья человека элемент и одновременно чрезвычайно токсичное вещество. Он был наречён задолго до того, как его удалось выделить в чистом виде. Его греческое имя φθόριος переводится как ‘разрушающий’, но более распространено его латинское название fluorum
, означающее ‘текущий’. Конечно же, речь о фторе. Так кто же он — разрушитель или созидатель?
Нобелевский лауреат по химии Фердинанд Фредерик Анри Муассан, впервые выделивший фтор. Фото: sv:Generalstabens litografiska anstalt / Wikimedia Commons / PD
История химии фтора действительно полна драматических страниц. Многие естествоиспытатели сильно пострадали, поплатившись здоровьем, а иногда и жизнью, пытаясь выделить этот элемент! Среди них — выдающиеся химики, имена которых хорошо известны каждому со школьной скамьи: швед Карл Вильгельм Шееле (1742–1786), англичане Хэмфри Дэви (1778–1829) и Джордж Гор (1826–1908), французские учёные Андре-Мари Ампер (1775–1836), Жозеф-Луи Гей-Люссак (1778–1850), Луи Жак Тенар (1777–1857), Эдмон Фреми (1814–1894) и Джером Никлес (1820–1869), бельгиец Полен Луе (1818–1850) и братья Томас и Джордж Нокс из Ирландии. Укротить этого химического дракона оказалось по силам лишь знаменитому французскому химику Анри Муассану (1852–1907).
В 1880 году Муассан защитил диссертацию, в которой обобщил результаты изучения оксидов железа и хрома. Но вскоре он изменил направление исследований и взялся ни много ни мало за решение проблемы выделения фтора. По воспоминаниям современников, его научные амбиции всегда были велики. Казалось, молодой экспериментатор готов бросить вызов любой опасности, пытаясь постичь неизведанное. И добился успеха: 26 июня 1886 года электролизом безводного фтороводорода, содержащего фторид калия, он впервые сумел выделить фтор, что, по мнению Эдмона Фреми, «является одним из величайших открытий в неорганической химии, которое может иметь для науки неисчислимые последствия». Уже через два дня об успехе Анри Муассана было сообщено на заседании Академии наук, а сам он представил краткое сообщение, осторожно озаглавленное «Действие электрического тока на безводную фтористоводородную кислоту». Такая нерешительность Муассана, по-видимому, связана с неудачами его предшественников, пытавшихся получить фтор: «Позволено мне будет не делать окончательных выводов о действии тока на фтористоводородную кислоту; сегодня я лишь сообщаю первые результаты; я продолжаю эти исследования и надеюсь вскоре представить на суд Академии новые эксперименты в этой области. Мы можем выдвигать различные гипотезы о природе полученного газа; логичнее всего было бы полагать, что это фтор…»
Анри Муассан получает фтор в своей лаборатории в Фармацевтической школе в Париже. Факсимиле мгновенной фотографии со вспышкой порошка из статьи de G. Tissandier // La Nature
, 875, 22 fevrier 1890, p. 177
Для проверки высказанной гипотезы Академия наук создала комиссию, в которую вошли самые именитые химики страны — Марселен Бертло, Анри Дебре и Эдмон Фреми. Муассан тщательно готовился к контрольному эксперименту. Специально для демонстрации опыта он получил очень чистый безводный фтороводород, что представляло немалые трудности. Вот как описывал этот процесс сам учёный:
«Получение чистой и безводной фтористоводородной кислоты начинают с приготовления гидрофторида калия (KHF2 — А. Р.
), соблюдая все предосторожности, описанные г-ном Фреми. После получения чистой соли её сушат на водяной бане при 100° и затем содержащую её платиновую чашку для выпаривания помещают в вакуум (вакуумный эксикатор. —
А. Р.
) в присутствии концентрированной серной кислоты и двух или трёх кусочков плавленого гидроксида калия в серебряном тигле. Кислота и едкий калий меняются каждое утро в течение пятнадцати дней, а вакуум поддерживается около 2 мм ртутного столба. Во время высушивания нужно не забывать ежедневно растирать соль в железной ступке для того, чтобы обновлять её поверхностный слой. После высушивания гидрофторид калия превращается в порошок, который может быть использован для получения фтороводородной кислоты».
Несмотря на такую тщательность, эксперимент не удался: фтор не выделился! К счастью, учёный очень быстро нашёл причину неудачи: без добавления фторида калия, который легко растворяется в HF, электролиз безводного фтористого водорода не проходил из-за низкой электропроводности последнего. Вернувшись к первоначальному варианту проведения эксперимента, Муассан в присутствии комиссии получил желаемый газ, о чём поведал Академии наук 19 июля 1886 года. Однако лишь в третьем сообщении «Новые эксперименты по разложению фтороводородной кислоты электрическим током», датированном 26 июля того же года, он уверенно заключил, что «газ, выделяющийся при электролизе безводного фтороводорода, несомненно является фтором». За это открытие учёный был отмечен Нобелевской премией по химии 1906 года.
Обложка журнала
Comptes Rendu
с первым сообщением Анри Муассана о выделении фтора. Фото с сайта biodiversitylibrary.org
«Во время этой долгой работы, — признавался позже Анри Муассан в своей книге „Фтор и его соединения“, — мы неоднократно имели возможность убедиться, насколько изучение соединений фтора далеко от завершения. Мы мало знаем о фторидах металлоидов (устаревшее название элементов, расположенных в таблице на границе между металлами и неметаллами. — А. Р.
), совсем немного о фторидах металлов, а наши знания об органических соединениях фтора просто скудны».
«Будет ли фтор иметь практическое применение?» — обращался он к слушателям во время лекции, прочитанной им в мае 1897 года в Королевском институте Великобритании. И тут же продолжал: «На этот вопрос очень сложно ответить. Однако со всей искренностью могу сказать, что, проводя исследования, я мало думал об этом. Полагаю, что все химики, чьи попытки предшествовали моим, тоже вряд ли задумывались над этим». Удивительно, что спустя почти сорок лет после выступления Муассана возможность использовать фтор или его соединения всё ещё была сомнительной. В вышедшем в 1934 году 25-м томе Технической энциклопедии (предшественницы многотомной Советской энциклопедии) утверждалось, что «вследствие затруднительности его получения и хранения фтор практического применения не имеет».
Однако сегодня химия органических соединений фтора — одна из привлекательных областей исследований химиков мира. Может показаться странным, что соединения, молекулы которых содержат связь углерод — фтор, очень редко встречаются в природе: к настоящему времени известно не более трёх десятков таких веществ. Среди них — фторуксусная кислота и её производные, выделенные из южноафриканских растений; фторацетон, содержащийся в произрастающих в Австралии низкорослых деревцах Acacia georginae
; производные 5-фторурацила, известного противоопухолевого препарата, выделенные из собранной в Южно-Китайском море губки
Phakellia fusca
; несколько фторсодержащих жирных кислот, например ω-фторолеиновая, обнаруженных в масле семян кустарника
Dichapetalum toxicarium
, произрастающего в Сьерра-Леоне. Все эти природные фторорганические соединения чрезвычайно токсичны, а содержащие их растения, бактерии и грибы занимают верхние строчки рейтинга самых смертоносных в мире.
Некоторые природные соединения, молекулы которых содержат связь углерод — фтор. Эти фторорганические соединения чрезвычайно токсичны
Несмотря на то что соединения фтора очень редко встречаются в природе, они играют исключительно важную роль в жизни человека. И если природные фторсодержащие вещества можно буквально пересчитать по пальцам, то число полученных химиками фторорганических производных уже перевалило за миллион! Таким образом, получается, что органическая химия этих соединений практически полностью создана человеком! Где же встречаются фторсодержащие продукты? В ответ на этот вопрос наверняка можно услышать: в зубной пасте или в покрытиях сковородок. Однако фторсодержащие вещества — это не только органический (аминофторид) либо минеральный (монофторфосфат или фторид натрия) компонент зубной пасты или антипригарное тефлоновое покрытие. Органические соединения фтора сегодня широко используются для разработки новых лекарственных средств и создания материалов с уникальными свойствами. По иронии судьбы, хотя элементарный фтор токсичен для всего живого, фторсодержащие препараты всё шире используются в медицинской практике. Если полвека назад доля таких лекарств составляла лишь 2%, то сегодня молекулы около трети всех выпускаемых агрохимикатов и фармацевтических препаратов содержат хотя бы один атом фтора, причём 20% их появилось на рынке в первое десятилетие нового столетия.
Фторорганические производные полезны при профилактике кариеса и изготовлении биокерамических протезов (ортопедических и зубных имплантатов), при лечении больных малярией, сердечно-сосудистыми, онкологическими и многими другими заболеваниями.
Некоторые из этих препаратов успешно применяются уже не одно десятилетие. Синтезированный в середине 50-х годов прошлого века 5-фторурацил, как производное пиримидиновых оснований — органических азотсодержащих гетероциклов, входящих в состав нуклеиновых кислот, сразу привлёк внимание медиков. Оказалось, что замена лишь одного атома водорода на фтор в молекуле урацила приводит к созданию цитостатика, проявляющего высокую антиметаболическую активность.
Другой фторсодержащий препарат — целекоксиб, выпускаемый под торговой маркой Целебрекс, — нестероидное противовоспалительное средство. После выхода на фармацевтический рынок в декабре 1998 года он стал одним из наиболее часто назначаемых препаратов. Разработанный нашей группой новый способ получения этого соединения и его аналогов был описан в статье, опубликованной в августе 2017 года в European Journal of Organic Chemistry
в рубрике «Very important paper».
Фторсодержащие лекарственные препараты широко используются для лечения разных заболеваний. В числе таких лекарств 5-фторурацил, целекоксиб, флуоксетин, аторвастатин, ципрофлоксацин
В 1996 году искусственный кровезаменитель Перфторан, представляющий собой эмульсию перфторуглеродов (производных углеводородов, в которых все атомы водорода заменены на фтор) в воде, был разрешён для медицинского применения и промышленного выпуска в Российской Федерации. О драматической истории его создания журнал «Наука и жизнь» писал ранее (см. «Науку и жизнь» № 2, 1999 г., статья «Переливание крови: против, за и альтернатива»).
Активность фторсодержащих лекарств — в частности одного из самых популярных антидепрессантов флуоксетина, выпускаемого уже более 30 лет, часто прописываемого терапевтами в качестве гиполипидимического средства группы статинов аторвастатина, антибактериального препарата широкого спектра действия ципрофлоксацина и других — как полагают, связана с присутствием в молекуле одного или нескольких атомов фтора. Почему же введение фтора или фторсодержащей группы (чаще всего CF3) в молекулу так изменяет физические, химические и биологические свойства исходного соединения? Поиск ответа на этот вопрос чрезвычайно важен для разработки новых лекарственных препаратов.
Ван-дер-ваальсовый радиус атома фтора (1,47 Å) лишь немного превышает радиус водорода (1,20 Å). Поэтому, с одной стороны, замена водорода на фтор незначительно увеличивает объём молекулы, а с другой — часто происходящие при этом конформационные изменения не могут не отразиться на взаимодействии лекарства с избранной биомолекулой-мишенью. Изменяются кислотно-основные свойства, а значит, и способность образовывать водородные связи, играющие важную роль в биологических системах. Известно, что для лучшего усвоения организмом лекарственное средство должно иметь высокую гидрофильность, хорошо растворяться в воде. Но преодолеть клеточную мембрану может только липофильная молекула. Происходящая при замене водорода на фтор модификация позволяет найти компромисс между этими двумя противоположными свойствами. Наконец, оборотной стороной экстремальной реакционной способности фтора является образование прочных связей фтор-элемент. Например, одинарная связь C—F обладает одним из самых высоких значений энергии диссоциации (~480 кДж/моль; для сравнения среднее значение этого параметра для связи C—H составляет ~420 кДж/моль). Отсюда — высокая устойчивость и химическая инертность фторорганических соединений. Более того, введение фтора защищает молекулу от метаболического разложения, повышая «выживаемость» лекарства в организме и продлевая его терапевтический эффект. А это в свою очередь позволяет уменьшить дозу лекарственного препарата. Однако летом 2021 года учёные Техасского университета в Сан-Антонио (США) сообщили о сенсационном открытии: оказалось, что вырабатываемые в организме человека ферменты способны расщеплять связь C—F в молекулах некоторых лекарств. Это открытие может повлиять на стратегию создания новых лекарственных препаратов.
Химия органических производных фтора никого не оставляет равнодушным. Каждый год химики мира синтезируют десятки тысяч новых фторорганических соединений. Учёные многих стран, ведущие исследования в этой области, ежегодно встречаются на научных форумах, чтобы поделиться достигнутыми успехами и наметить пути дальнейшего развития удивительной химии необычного элемента, занимающего девятую клеточку Периодической таблицы. И хотя за последние годы учёные существенно продвинулись в понимании уникальных и загадочных свойств фтора, несомненно, этот необычный элемент хранит ещё много тайн.
Липофильность (от греческого λιπος — ‘жир’ и φιλος — ‘дружественный’) — способность химического соединения растворяться в жирах, маслах и неполярных растворителях.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
В некоторой степени относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Распространенность Фтора
По распространенности во Вселенной фтор занимает 24 место. Его присутствие в космосе оценивается как низкое. Для сравнения остальные элементы группы могут встречаться до 20 раз больше. Если взять соотношение, то количество фтора в районе 400 частей на миллиард. Такая низкая концентрация связана с тем, что процессы звездного нуклеосинтеза протекают без присутствия фтора. Любые образованные атомы фтора имеют высокое ядерное сечение, что в дальнейшем позволяет слиться с водородом или гелием для концентрации кислорода или неона.
Что же касается Земли, то фтор является тринадцатым по распространенности в земной коре. По массе соотношение частей варьируется около цифры 400 частей на миллион. Фтор, как чистое вещество, в природе не встречается. Вместо этого он встречается в виде фторсодержащих минералов. Самым распространенным из них является флюорит (CaF2). На нашей планете более 9 тысяч месторождений этого минерала. Крупнейшими поставщиками флюорита являются Китай и Мексика. Еще двумя фторсодержащими минералами являются фторопатит, топаз и криолит.
Читайте: Углерод как химический элемент таблицы Менделеева
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны еще 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Фторирование зубов в стоматологических
В проводится глубокое фторирование по современной A.P.F. системе.
Фторирование зубов — процедура для профилактики и укрепления поверхностных и глубоких слоев тканей зуба. Для зубов необходимы два вещества – кальций и фтор, но они все время вытесняют друг друга с поверхности эмали. Поэтому появился новый препарат A.P.F. гель, на основе нанотехнологий, который способен насытить глубокие слои эмали кальцием, а верхние – фтором. В процедура фторирования зубов по A.P.F. системе занимает 10-20 минут. Для закрепления эффекта от процедуры на дом выдается средство для дальнейшего домашнего ухода. Данная процедура позволяет не только защитить зубы от кариеса, но и восстановить эмаль с уже имеющимся на поверхности кариесом.
Электронное строение
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
В каких продуктах содержится фтор
Необходимый для человеческого организма фтор содержится в следующих продуктах питания:
- грецкий орех и миндаль;
- рыба морская и пресноводная;
- морепродукты (особенно креветки);
- овощи (картофель, тыква, лук, спаржа, авокадо, брюссельская капуста, помидоры, морковь, листовой салат, шпинат и другая зелень);
- яйца;
- фрукты (грейпфрут, яблоко, мандарин, сливы);
- злаки (гречка, рис, кукуруза, овес, отруби, проросшие зерна);
- говядина и курица;
- мед;
- соленья (соленые огурцы, помидоры, капуста);
- молоко;
- черный и зеленый чай;
- красное вино (источником здесь выступают химикаты, которыми удобряют виноград).
Для того, чтобы получать необходимое количество фтора, вовсе не обязательно принимать аптечные препараты. Достаточно включать в свое меню продукты из приведенного списка, но и не допускать передозировки данного элемента.
Получение
Лабораторный метод получения фтора
Источником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Острое отравление[править | править код]
Источники F
Такое отравление — не редкость. Обычно оно возникает вследствие случайного попадания в организм фторсодержащих инсектицидов или средств против грызунов.
Первые симптомы (слюнотечение, тошнота, боль в животе, рвота и понос) связаны с местным действием соединений фтора на слизистую ЖКТ. Системные симптомы разнообразны и тяжелы: нервное возбуждение (обусловленное, по-видимому, кальцийсвязывающим действием ионов фтора), гипокальциемия и гипогликемия. АД снижается, что можно объяснить как угнетением сосудодвигательного центра, так и прямым кардиотоксическим действием. Дыхание вначале учащается, но затем угнетается. Смерть обычно наступает от остановки дыхания или сердечной недостаточности. Смертельная доза фторида натрия для человека составляет примерно 5 г, хотя и значительно колеблется. Лечение сводится к в/в введению физиологического раствора с глюкозой и промыванию желудка известковой водой (0,15% раствором гидроокиси кальция) или растворами других солей кальция для связывания ионов фтора. При тетании вводят кальция глюконат в/в. С помощью интенсивной инфузионной терапии поддерживают высокий диурез.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
XeF8 → XeF6 + F2 MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Недостаток фтора в организме
Поскольку основным источником фтора для человека является вода, необходимо следить за тем, чтобы этот элемент содержался в ней в достаточном количестве.
Недостаток фтора в организме может выражаться следующими симптомами:
- секущиеся кончики, ломкость, сухость и выпадение волос:
- развитие кариеса, повышенная чувствительность эмали, крошение зубов, повышенная стираемость, эрозии и некрозы десен;
- частые и повторные переломы, трещины и трудности со срастанием костей, что может быть признаком остеопороза;
- подверженность простудным и вирусным заболеваниям по причине ослабленного иммунитета.
Наиболее эффективным способом устранения недостатка фтора в организме является замена источника питьевой воды. Необходимо выбирать бутилированную воду с содержанием данного элемента. При значительном дефиците фтора, подтвержденном анализами, назначается соответствующая терапия. Улучшить состояние зубов можно при помощи фторсодержащей пасты, подбирать которую должен профессиональный стоматолог.
Способ восполнения минерала выбирается исходя из симптоматики и наличия либо отсутствия сопутствующих заболеваний и противопоказаний. Рассчитывая дозировку того или иного препарата для пополнения запасов фтора, следует избегать превышения дозы, так как этот элемент содержится в некоторых продуктах, воде и витаминах. По этой причине лучше обратиться к врачу для выбора необходимого средства и его дозировки.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности. трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами фреонов — хороших хладагентов тефлонов — химически инертных полимеров гексафтороалюмината натрия — для последующего получения алюминия электролизом различных соединений фтора
Ракетная техника
Соединения фтора широко применяются в ракетной технике как окислитель ракетного топлива.
Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Применение
Значит. часть cвободного Ф. идёт на получение разнообразных фторсодержащих материалов (электролитов, растворителей, лаков, ПАВ, смазочных жидкостей, инсектицидов, пестицидов, заменителей крови, фармацевтич. препаратов и др.). Ф. используют в произ-ве гексафторида урана UF6, трифторида бора BF3, фторидов графита CFn и др. элементов (WF6, NF3, SF6, CF4, SbF5, XeF6 и др.). Применяют в эксимерных лазерах на ArF* или KrF*.
Ф. высокотоксичен. Раздражает кожу, слизистые оболочки носа и глаз; вызывает дерматиты, ожоги кожи, конъюнктивиты, отёк лёгких.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Польза фтора для организма человека
Фтор приносит большую пользу для организма человека.
Он выполняет множество важных функций:
- Угнетает развитие патогенных микроорганизмов, предупреждая повреждение зубной эмали продуктами их жизнедеятельности.
- Выводит соли и тяжелые металлы.
- Реминерализует эмаль на первой стадии образования кариеса.
- Способствует укреплению костной ткани.
- Нормализует фосфорно-кальциевый обмен.
- Повышает устойчивость организма к радиации.
- Замедляет работу кислотообразующих бактерий.
- Отвечает за качество волос и ногтей.
Дополнительная информация
Фториды Соединения фтора в ракетной технике Соединения фтора в медицине Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями. Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.